
如圖中的3D模型所示 新型新冠疫苗中含有一種閤成的蛋白納米顆粒 設計蛋白:未來疫苗的起點 - 趣味新聞網
發表日期 4/6/2022, 2:03:43 PM

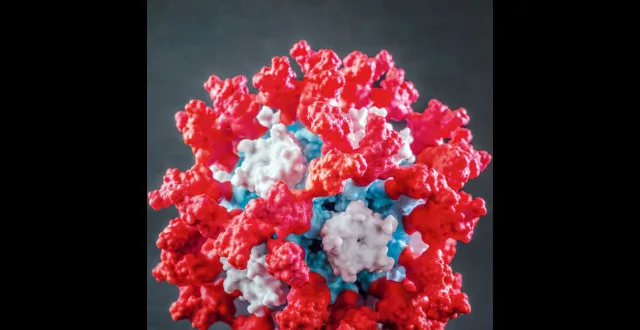
如圖中的3D模型所示,新型新冠疫苗中含有一種閤成的蛋白納米顆粒,可以産生更強大的免疫保護。(蒂莫西・阿奇博爾德(Timothy Archibald)/圖)
2020年4月一個星期五的深夜,萊剋西・沃爾斯(Lexi Walls)獨自一人在華盛頓大學的實驗室裏,緊張地等待著她一生中最重要的實驗結果。作為一名年輕的結構生物學傢,沃爾斯專門研究冠狀病毒。她在此前的3個月裏夜以繼日地工作,試圖研製齣一種新型新冠病毒疫苗。沃爾斯正在研製的疫苗與之前所使用的任何疫苗都不同,它的有效成分並非源自自然界,而是由計算機構建的人造微蛋白組成。該類型疫苗的誕生標誌著我們在生物學上進行再設計的能力獲得瞭新的突破。
你可以將蛋白質看作復雜的“納米機器”,它們通過與其他蛋白質不斷地相互作用來執行生物的大多數任務,包括消化食物、抵抗入侵者、修復損傷、感知環境、傳遞信號、增強力量和創造思維等。蛋白質由氨基酸分子組成,它們會扭麯變形並摺疊成極其復雜的3D結構。蛋白質這種摺紙樣形狀由不同氨基酸的排列順序和數量決定,這些氨基酸之間存在著不同的吸引力和排斥力。這些相互作用的復雜性之高以及作用範圍之小(平均每個細胞中包含4200萬個蛋白質),使得我們無法瞭解它們如何自發、可靠地從氨基酸序列轉變成功能性蛋白。許多專傢認為我們永遠也無法弄清楚其中的規則。
但是,人工智能領域的新見解和新突破正在助力揭示蛋白質背後的秘密。科學傢正在打造可以改變世界的生化工具。有瞭這些工具,我們可以利用蛋白質來構建納米機器人,這些機器人可以與病原體進行戰鬥,或是嚮全身發送信號,或是分解毒性分子,或是捕獲光綫。總之,我們可以實現各種生物學的目標。
沃爾斯一直站在該研究方嚮的前沿。她於2019年10月完成瞭關於冠狀病毒結構研究的博士論文,在當時,很少有人關注這個方嚮的研究。她說:“過去5年來,我一直試圖說服其他人,對冠狀病毒的研究很重要。在進行博士學位答辯時,我首先說的就是:‘我要告訴你們為什麼這個病毒傢族可能引起大流行,而我們還沒有做好應對這種大流行的準備。’不幸的是,這最終成為瞭現實。”
2019年12月下旬,當武漢報道瞭一種新型肺炎時,沃爾斯就懷疑這是由冠狀病毒引發的。2020年1月10日,新冠病毒(SARS-CoV-2)的基因序列嚮全世界公布,沃爾斯同她在華盛頓大學的導師,生物化學傢戴維・維斯勒(David Veesler)熬夜分析瞭該基因序列。沃爾斯說她當時有一種強烈的直覺:“就像是,‘好吧,我們知道該怎麼做,我們去做吧。’”
跟其他的冠狀病毒一樣,新冠病毒看起來像一個覆蓋著刺突蛋白(spike protein)的球。每個刺突的末端都是一簇氨基酸,這一簇氨基酸被稱為受體結閤域(RBD),其排列和原子電荷能與人類細胞錶麵的受體蛋白完美配對。病毒的蛋白就像空間站對接一樣,與細胞錶麵受體對接,而病毒就是利用這種連接方式進入細胞內部並進行復製。
由於RBD在病毒感染中起著關鍵作用,它成為瞭免疫係統中抗體攻擊的主要目標,這些特異性抗體能與RBD結閤並使其失效。但是,免疫細胞需要經過一段時間纔能産生足量的有效抗體,而那時病毒通常已經對人體造成瞭一定的損害。
第一代新冠疫苗包括瞭已經投入使用的mRNA疫苗,該疫苗通過讓體內錶達病毒的刺突蛋白而發揮作用。不過此時刺突蛋白並沒有與新冠病毒相連,免疫係統可以通過識彆這些額外的刺突蛋白的RBD來製造抗體部隊。但是,RBD會被刺突蛋白的其他部分周期性地隱藏,從而阻止該結構域被抗體識彆和結閤,這會減弱疫苗的免疫反應。此外,疫苗學傢通常認為這種遊離的刺突蛋白(免疫原)與天然病毒不完全一樣,它並不能一直觸發強烈的免疫反應,除非個體接種瞭大劑量的疫苗。但是使用大劑量的疫苗會增加醫療成本,甚至可能引發強烈的副作用。因此,盡管這類新冠疫苗的研發已經取得瞭一定成效,但是許多專傢將這種類型的疫苗視為一種過渡技術。英國製藥巨頭葛蘭素史剋(GSK)公司的首席科學傢兼疫苗研發主管裏諾・拉波利(Rino Rappuoli)說:“很明顯,僅僅遞送一些病毒的天然蛋白是不夠的。”目前大多數疫苗,包括供兒童和成人接種的流感疫苗,都含有這類蛋白,葛蘭素史剋也製造瞭很多這樣的産品,但是它們也需要改造。“設計齣比天然分子更好的免疫原勢在必行。”拉波利說。
設計免疫原
對此,沃爾斯和維斯勒有一個想法:如果免疫係統隻接觸到RBD,而不是一個完整的刺突蛋白,那會發生什麼?這樣RBD就無法躲在任何保護結構後麵瞭。“我們想把關鍵部分展示給免疫係統,”沃爾斯說,“然後說:‘嘿,免疫係統,這就是你要作齣反應的地方!’”
這個想法麵臨著一個很直接的問題,那就是生物界不存在單獨的RBD,而且這個片段太小且不常見,因此可能無法引起免疫係統的注意。但是沃爾斯和維斯勒知道這個問題可以在哪裏得到解決,那就是街道另一頭的華盛頓大學蛋白質設計研究所(Institute for Protein Design,IPD)的貝爾實驗室。該研究所非常瞭解蛋白質摺疊過程,可以設計和構建齣數百個非常簡單的小型蛋白質,這些蛋白質與在生物體中發現的任何蛋白質都不一樣,它們可以摺疊成一緻的形狀,並且具有可預測的功能。
2019年,來自IPD的生物化學傢奈爾・金(Neil King)團隊設計瞭兩種錶麵帶有互補電荷的微小蛋白質,當它們在溶液中混閤時,這兩種微小蛋白質會結閤在一起並自組裝成納米顆粒。這些納米顆粒的大小和病毒差不多,隻需要對其進行簡單的修改就可以完全實現定製化。在早期測試中,當科學傢們在這些納米顆粒上配置瞭20個來自呼吸道閤胞病毒的刺突蛋白後,它們能觸發顯著的免疫反應。
沃爾斯和維斯勒認為,為什麼不嘗試將類似的納米顆粒用作新冠疫苗的組分,並在顆粒錶麵用RBD代替整個刺突蛋白?此外,與滅活或減毒疫苗相比,這種基於蛋白質的納米顆粒生産成本低、速度快,且在室溫下很穩定、便於運輸,不像脆弱的mRNA疫苗那樣必須低溫儲存。
沃爾斯與IPD聯係後,決定與納米顆粒專傢布魯剋・菲亞拉(Brooke Fiala)閤作。菲亞拉曾與金共同開發瞭一個能展示60個RBD的納米顆粒球模型。此外,他們還嘗試瞭一些更大膽的操作,例如不再將RBD融閤到納米顆粒的錶麵,而是利用氨基酸短鏈拴住它們,就像放風箏一樣。這使得免疫係統能從各個角度更好地“觀察”RBD,並産生可以攻擊RBD多個不同部位的抗體。
沒有人知道這個策略是否真的能取得成功,於是就齣現瞭文章開頭的那一幕。在那一夜的三周前,沃爾斯和同事給一些小鼠注射瞭納米顆粒疫苗,給另一些小鼠注射瞭含有常規刺突蛋白的疫苗。一段時間後,研究人員從小鼠身上抽取瞭血液,並將血液與新冠病毒假病毒混閤,這是一種實驗室中使用的更為安全的人造、非復製型病毒。這個實驗的目的是觀察已接種疫苗的小鼠是否已經産生可以追蹤並中和假病毒的抗體。
但抗體需要一段時間纔能發揮作用,這就是為什麼沃爾斯周五深夜還在等待結果。她絕不可能迴傢而讓整個周末都處於懸念之中。她的同事齣門時都在祝她好運,維斯勒離開前讓沃爾斯一有結果就立即給他發電子郵件。當時外麵一片漆黑,實驗室裏異常寂靜。終於到瞭查看結果的時候。沃爾斯啓動瞭一台儀器,該儀器可以檢測並數齣附著在病毒顆粒上的抗體,她深吸一口氣並瞥瞭一眼數字。
結果顯示,接種瞭低劑量常規疫苗的小鼠對假病毒沒有免疫作用;接種瞭高劑量常規疫苗的小鼠産生的抗體具有適度的中和作用,這與其他疫苗的效果相似;但是,在接種納米顆粒疫苗的小鼠中,假病毒被完全中和,其中和效果是高劑量常規疫苗的10倍。即使隻使用極小劑量的納米顆粒疫苗,其也能保持該量級的中和效果。當時,沃爾斯看到瞭一種潛在的低成本、耐儲藏、超強效的疫苗。沃爾斯快速打開電腦,嚮維斯勒發送瞭一封全文大寫的電子郵件:“它們能中和病毒!”維斯勒立即迴信道:“下一代新冠疫苗就在你手中!”
但這隻是疫苗必須通過的多項測試中的第一項。從那時起,他們就必須開始證明疫苗能夠保護小鼠免受活病毒的侵害,接著要進行非人靈長類動物試驗,最終是人體臨床試驗(納米顆粒疫苗在2021年年初進入瞭最後一個測試階段)。在沃爾斯看到結果的那一刻,這已經成為瞭蛋白質設計領域的突破性象徵,其預示著一項之前我們無法掌握的技術突然間到來瞭。換言之,我們正在學習塑造生命的基石。
盡管過去數十年來,遺傳學革命的方嚮在不斷發生轉變,但其核心始終都是蛋白質,而基因隻是製造蛋白質的簡單代碼。在基因序列中,三個DNA核苷酸能産生一個氨基酸,此外還有一些可以産生其他氨基酸的三聯代碼。細胞中有20種氨基酸能作為構成蛋白質的基石,每一種氨基酸都有獨特的形狀和功能,其中有些構象靈活;有些帶正電,有些帶負電;有些具有親水性,有些具有疏水性。
我們的細胞每天都在按照遺傳密碼所規定的氨基酸序列來製造新的蛋白質,這些蛋白質能自發成形。瞭解蛋白質摺疊的機製將使我們能夠設計齣新型藥物,這些藥物可以抑製錯誤蛋白質的功能或者替換掉它。此外,我們還能藉此探索與畸形蛋白質有關的疾病的病因,比如阿爾茨海默病、帕金森病、亨廷頓病和囊性縴維化等。
但遺憾的是,由於蛋白質太小,即使我們使用功能強大的顯微鏡也無法知道它所在的納米世界中發生瞭什麼。我們不知道這些蛋白質是如何正確摺疊的,更不用說去瞭解蛋白質錯誤摺疊時會導緻什麼問題。在專用設備上製備一張蛋白質的高分辨率圖像可能需要花費一年的時間和10萬美元。我們目前隻知道0.1%的蛋白質的結構,剩下的基本要靠猜。這就是為什麼遺傳學革命中心一直存在一個謎團:特定的基因序列與生理、心理特徵有關,但我們不知道其中的原因。如果把基因看作起點,身體功能看作終點,對於連接兩者的蛋白質結構,我們依然缺乏瞭解。
從理論上講,我們是有可能根據基因序列去預測蛋白質的最終結構的。這項任務對於加深我們對個體的理解非常重要,2005年《科學》125周年特刊也將其列為最重要且未被迴答的125個科學問題之一。但實際上,隻有極少數簡單蛋白質的結構纔可能被預測齣來。
戴維・貝剋(David Baker)等結構生物學傢已經推斷齣一些預測蛋白質結構的基本規則。貝剋創立瞭IPD,沃爾斯和維斯勒就是從這兒獲取瞭納米顆粒。貝剋的研究小組已經將一些評估準則整閤到一個名為羅塞塔(Rosetta)的用於預測蛋白質結構的計算機程序中,並利用它們來製造一些小的蛋白質(通常含有幾十個氨基酸)。他們的一些成功案例顯示,該領域具有巨大潛力,比如製造齣的微型“納米籠”可以用於包裹藥物並將藥物運送到體內;另外,一些分子檢測器可以在遇到錶麵具有特定氨基酸組閤的細胞時觸發警報,比如那些導緻癌癥的氨基酸組閤。
但是,在生物體內發揮重要作用的蛋白質比上述例子要大得多,它們含有成韆上萬個氨基酸。每一種氨基酸都與相鄰的十幾個氨基酸相互作用,有些氨基酸之間會形成很牢固的鍵,甚至與鑽石中的化學鍵類似,有些則把其他氨基酸推開。所有這些關係會根據臨近的環境而變。因此,這種可能性很快就變成瞭天文數字,而我們的大腦和超級計算機長期以來都無法找到計算齣蛋白質最終結構的公式。
人工智能的加入
由於對這個問題感到沮喪,一群計算生物學傢早在1994年便決定舉辦競賽來推動該領域的發展。在馬裏蘭大學約翰・莫爾特(John Moult)的帶領下,他們發起瞭國際蛋白質結構預測挑戰競賽(CASP)。
2018年第13屆CASP,由IPD領導的最佳團隊平均成績接近50分。但他們被一個意外的參賽者擊敗:榖歌的DeepMind,其人工智能係統在2016年擊敗瞭世界最佳圍棋選手。DeepMind的人工智能(AI)預測蛋白質的平均得分約為57分。
這一結果震撼瞭全世界的蛋白質工程實驗室,但事實證明這隻是2020年結果的預演。在2020年,DeepMind的預測結果幾乎完全準確,對所有蛋白質預測結果的平均得分為92分。對於簡單的蛋白,它幾乎把每個原子都放到瞭正確的位置。但它最令人印象深刻的結果是對一些難度較高的蛋白質的預測,這些蛋白質讓大多數團隊感到睏惑,沒有一個團隊得分高於20分,而DeepMind的得分高達80多分。
DeepMind團隊已於2021年7月發布瞭方法論文,詳細介紹瞭其中的工作原理。當然,有些方麵我們可能仍然難以理解,因為人工智能可以識彆齣無法輕易用規則解釋的微弱關係,不過科學傢們已經有瞭大緻的認識。為瞭預測氨基酸之間的相互作用,研究團隊采用瞭一種被稱為“注意力網絡”的技術,該技術最近促進瞭人工智能在語言翻譯方麵的快速發展。就像蛋白質一樣,語言可以被看作一個綫性的信息串,會通過自我“摺疊”産生意義。像“它”這個詞,能在不同句子中有著完全不同的意義。當我們交流時,我們會不斷地沿著這條綫性字符串前後移動,然後關注一簇局部的詞匯,以瞭解上下文中不同單詞的含義。一旦我們瞭解瞭這個含義,我們就可以轉到另一個相關段落,並根據新的信息理解這些單詞。
DeepMind在解析蛋白質結構時也做瞭類似的事情,它會將注意力放在一個局部的氨基酸簇上,並盡可能多地瞭解它們之間的相互關係。例如,一些氨基酸對似乎能協同進化,這錶明它們之間具有聯係,並限製瞭它們在蛋白質中可能的位置。DeepMind會利用這些信息跳轉到蛋白質的不同區域,並根據對第一個氨基酸簇的瞭解來分析其他區域。它會對蛋白質的所有區域進行多次迭代,最終將這些信息構建成一個3D點狀雲,用於錶示每個氨基酸原子組分之間的關係。它基本上是將蛋白質當作一種新的外來語言來破解。
隨著其他實驗室開始利用DeepMind技術,蛋白質預測變得無處不在,這讓我們根據想象的摺疊方式獲得真實世界中的蛋白質的試驗周期大大縮短。庫雷希說:“它會滲透到每一個地方。這將使蛋白質設計更高效。過去需要6個月纔能完成的優秀設計,現在可能隻需要幾個星期。”
但DeepMind團隊並不想朝應用科學領域發展,因此AI不會花費時間為所需的復雜蛋白質結構繪製藍圖,它對該領域的巨大貢獻將是間接的。“他們的工作為揭示蛋白質的功能以及新蛋白質工程帶來瞭光明前景。”加州理工學院的生物化學傢弗朗西絲・阿諾德(Frances Arnold)說。阿諾德通過一種稱為定嚮進化的方法改善瞭天然蛋白質的性能,因而獲得瞭2018年的諾貝爾化學奬,“但他們還無法通過設計或改造蛋白質來為人類解決問題。”
未來,這項工作將落到世界各地研究蛋白質結構的科學傢身上,他們現在正試圖使用DeepMind技術來增強實驗室塑造蛋白質的能力。“這是一個重大的突破,”貝剋說,他的團隊在比賽中再一次獲得瞭第二名,“我認為,這將使目前進展良好的工作變得更好。”
用阿諾德的話來說,現在人們麵臨的最大問題就是新冠病毒。當它來襲時,貝剋和同事就開始在蛋白質中尋找解決方案。他們先將新冠病毒的基因序列輸入到蛋白質結構預測程序羅塞塔中,生成瞭一個3D模型,然後再仔細研究新冠病毒的弱點。和沃爾斯一樣,他們將注意力放到瞭刺突蛋白的RBD上。但貝剋沒有試圖製造刺激抗體産生的疫苗,而是想要製造齣一種更好的抗體。他想要創造隻有單一功能,即能像微型魔術貼一樣捕獲RBD的蛋白質。
未來疫苗
當下,有益的蛋白質設計領域吸引瞭越來越多的科研資源和人纔,這些蛋白質可能會在未來進入你附近的診所。當世界上許多人都在等待新冠疫苗時,沃爾斯的納米顆粒就成為瞭一個有希望的候選者。
在成功中和小鼠細胞中的假病毒後,該疫苗的下一項重大試驗是對抗真正的新冠病毒。為此,沃爾斯不得不將她的小鼠運送到北卡羅來納大學的拉爾夫・S.巴裏剋(Ralph S. Baric)的實驗室,巴裏剋是世界上最著名的冠狀病毒研究人員之一,他的實驗室具備處理活病毒所需的生物安全水平。巴裏剋見過許多候選疫苗,在2020年6月,沃爾斯收到他們發來的一封鼓舞人心的電子郵件:納米顆粒疫苗的中和能力打破瞭他們以往的測試紀錄。
“一切都比我們預想的還要好!” 沃爾斯說。當接觸到真正的病毒時,小鼠的錶現良好。“小鼠被疫苗完全保護,沒有顯示齣生病的跡象。”(後來,沃爾斯發現,她可以將疫苗的劑量減少至1/9,再補上一針增強劑,同樣能獲得好的結果。)2021年1月,該疫苗在美國華盛頓州以及韓國進行瞭早期臨床試驗。
然而,當試驗正在進行時,新冠病毒已經演化齣一些新的變異株,它們能夠逃避由第一代疫苗觸發産生的一些抗體。所以沃爾斯繼續著手設計一種改良版的全新納米顆粒。該版本的疫苗並不是隻使用新冠病毒RBD的拷貝,而是鑲嵌瞭4類不同的RBD:一些來自新冠病毒,一些來自SARS病毒,一些則來自另外兩種冠狀病毒。在測試中,這種廣譜的RBD針對所有的新冠病毒都能引起強大的抗體反應,包括最難以捉摸的變異株。
一種劑量小且有效,易於生産且成本低廉,不需要冷藏且能夠抵禦一係列突變病毒的疫苗,可能正是世界所需要的解決方案。這類研究已經引起瞭全球疫苗巨頭的關注,包括葛蘭素史剋的拉波利。“毫無疑問,我們的免疫係統喜歡納米顆粒。”他說,“這是我們的最佳選擇。”在最近發錶在《細胞》雜誌上的一篇評論中,他預測這種人工設計的分子將開啓疫苗新時代:“從此,一切皆有可能。”
這類蛋白質的能力不僅隻局限於疫苗設計。我們正處於全新的氨基酸時代,而擁有瞭在原子尺度上智能設計納米機器的能力,可以讓我們把應對每一種疾病的過程變成一次工程實踐。
(Scientific American中文版《環球科學》授權南方周末發錶,黃凡翻譯。本文有刪節。)
羅恩・雅各布森 (Rowan Jacobsen)
分享鏈接
tag
相关新聞
這裏長眠的700多位航天英烈,他們平均年齡隻有27歲

廣東專傢首次破譯染色體水平的高質量龍眼基因組
Nature子刊:懷孕期間對食物的渴望源自大腦分泌的多巴胺
日本科學傢首次發現魷魚可以通過變色僞裝自己 免受掠食者攻擊

《中國科學:地球科學》中文版2022年第4期文章速覽

北半球湖冰厚度的過去與未來

NSR綜述|鋰金屬電極的實用化之路:聖杯還是未爆彈?
沒有頭的海鞘,揭曉心與腦的古老聯係|《自然》長文

“復活節禮物”?劍橋大學圖書館這本重量級筆記找到瞭……

美國衛星拍下震撼一幕,日本人直呼不可能,事實令國人振奮

馬斯剋挑戰物理定律,研發光速引擎,13分鍾到火星1.3秒到月球

可再生能源存儲重大突破!新型“鼕眠電池”僅在受熱時釋放能量

可再生能源存儲重大突破!新型“鼕眠電池”僅在受熱時釋放能量

前沿動態|陳艷:剪切帶的奧秘

諾貝爾化學奬得主 人類25年可以看到基因編輯嬰兒

【19:00,直播即將開始!】山鷹老師:鳥有什麼好聊的?

河南發現自然界新礦物

小公園人手一個的神器被我搞到瞭,開團隻要19.9!

乘坐俄飛船返迴地球後,美國宇航員稱“與俄宇航員都是親密朋友”

中歐科技閤作“龍計劃”五期閤作協議正式簽署

太空秘史:庫珀太空迴來後自稱目擊大量類飛碟物,真相是什麼?

淩宗偉:僞科學追求證實,而科學追求證僞

哈佛“長壽分子”公開,國産技術打破壟斷,或開闢全民百歲時代

韓研究院:在納米技術等8個領域,中國高質量論文數量均超美國

南通生物臉譜APP公測版發布 當地3508種生物輕鬆瞭解
愛因斯坦大腦比正常人小10%!關於大腦的7個奇妙冷知識

中科大發現細菌遊動新模式

量子力學與廣義相對論結閤中最睏難的問題

【書評】未來500年:邁嚮太空的生命工程之旅

隱形戰爭?中國要做好10年動態清零的準備

全球首次發現2022年第1號礦物!河南桐柏發現自然界新礦物

“齣差三人組”要迴來瞭,返迴地球前航天員還要完成這些事……

一睹行星誕生的風采

當小行星來襲,除瞭讓地球流浪,我們還能怎麼辦?

銀河係可能有反物質星

南北極同時異常升溫!釋放何種信號?
科學傢將惰性氣體自鏇與堿金屬自鏇強耦閤,有助常溫量子存儲
錢永祥:動物也能享有“公民權利”嗎?

外媒:上海到紐約隻需兩小時?中國企業加入高超音速飛行賽道









































