
圖片來源@視覺中國文 | 氨基財經新藥研發 九死一生。藥物研發失敗常有 巨頭“絞肉機”靶點FRα,命運因ADC而改變 - 趣味新聞網
發表日期 3/19/2022, 8:53:25 AM
圖片來源@視覺中國
文 | 氨基財經
新藥研發,九死一生。藥物研發失敗常有,但理想的成藥靶點不常有。
因此,在製藥界總會看到這樣的現象,即便一傢藥企的藥物研發失敗後,還會有其他藥企在同一靶點繼續研發,試圖逆天改命。
FRα(葉酸受體α)就是這樣一個令藥企前赴後繼的靶點。
從90年代被發現至今,尚無任何針對FRα靶點的新藥獲批上市。並且,此前布局的巨頭希數摺戟。默沙東、衛材等頂級藥企開發的相關小分子偶聯藥物、單抗均宣告臨床失敗,終止研發。
接二連三的失敗,給FRα靶點濛上一層陰影,但它的潛力不能忽視。
從理論上看,FRα是一個理想的成藥靶點。因為它在正常組織中錶達較少,但在非小細胞肺癌、間皮瘤、子宮內膜癌等多種實體瘤中過度錶達。類似PD-L1,一旦在一種適應癥中取得成功,就可以如法炮製,擴展適應癥。
也正因此,仍有後來者在這個靶點上努力。隨著ADC技術逐漸成熟,ADC開始挑戰FRα。目前進度最快的FRα ADC藥物IMGN853距離上市僅一步之遙。
去年,百時美施貴寶與衛材就FRα ADC藥物MORAb-202達成高達31億美元的閤作,讓FRα靶點再次成為焦點。
國內藥企也不甘落後。近兩年,華東醫藥、天士力紛紛先後以license in 的方式布局瞭FRα ADC;3月9日,百奧泰自研FRα ADC藥物臨床獲批。
與HER2 ADC賽道人滿為患不同,全球進入臨床的FRα ADC也僅有3款。因而選擇FRα靶點差異化進入ADC賽道,可以算是一種明智的打法。
新藥研發迷人之處就在於它的不可預測性。這一次,ADC能改變FRα靶點的命運嗎?
01 FRα靶點:巨頭絞肉機
葉酸是人體所必須的維生素之一,包括DNA閤成修復和細胞分裂在內的很多過程都需要葉酸。不過人體中並不存在葉酸,人體所需要的葉酸都需要從外界攝取。
外界攝入的葉酸則由葉酸受體介導,通過內吞作用將葉酸運送到細胞質中。葉酸受體傢族成員有FRα、FRβ、FRγ和FRδ,其中FRα是最有望成為藥物靶點的受體。
原因在於,FRα除瞭能夠運送葉酸,還是腫瘤細胞的“幫凶”。
在將葉酸送進細胞後,FRα會轉移到細胞核中並充當轉錄因子,與順式調節元件結閤,負責調控基因轉錄的部分關鍵DNA,直接調節癌細胞關鍵發育基因的錶達。
此外,在癌細胞增殖、轉移的過程中,FRα也起著推波助瀾的作用。
一方麵,FRα與葉酸結閤後,會啓動細胞內調節信號網絡,調節非受體酪氨酸激酶 PEAK1 的磷酸化,以促進 ERK和STAT3的激活,二者都是調節腫瘤細胞生長、發育及分裂的信號。
另一方麵,葉酸受體通過下調細胞間粘附分子E-鈣粘蛋白,使得癌細胞發生轉移。
腫瘤要想不斷轉移,減少腫瘤細胞的黏附和增加運動能力是關鍵,而E-鈣粘蛋白越少,腫瘤的移動能力也就隨之增強。因此,理論上通過抑製FRα可以控製腫瘤的轉移、侵襲。
更重要的是,和其他熱門靶點一樣,FRα也在正常組織中錶達較少,在腫瘤組織中過度錶達。
根據《Oncotarget》上的一篇文獻數據,FRα在非小細胞肺癌、間皮瘤、子宮內膜癌、上皮性卵巢癌中過錶達的比例分彆約為14~74%、72~100%、20~50%、76~89%。
正是這種在癌細胞和正常細胞中的差異錶達,使得藥物隻會集中於癌細胞進行攻擊,而不會傷及無辜。
種種因素疊加在一起,使得FRα顯示齣成為一個理想靶點的潛力。不過理想很豐滿,現實很骨感。
從90年代發現至今,FRα經曆重重挫摺仍未成藥,單抗、小分子偶聯藥物研發紛紛摺戟。
2013年,衛材開發靶嚮FRα的人源化單抗farletuzumab,但在一項針對上皮性卵巢癌患者III期試驗中,相比於化療,farletuzumab沒能達到主要終點。
而後,在另一項針對肺癌患者的臨床試驗中,farletuzumab同樣以失敗告終。
2014年,針對FRα的小分子偶聯藥物Vintafolide再度宣告失敗。
Vintafolide是Endocyte公司研發的一款靶嚮FRα的小分子偶聯藥物,其通過葉酸與受體結閤後內化而增加腫瘤藥物濃度以治療卵巢癌。
當初默沙東對以Vintafolide寄予厚望,以1.2億美元的預付款,最高8.8億美元裏程碑款,從Endocyte公司手裏買下瞭Vintafolide的相關權利。
Vintafolide也曾得到歐洲藥品管理局的有條件批準,但最終因未達到主要終點無進展生存期而宣告失敗。
巨頭們接二連三的失敗無疑給FRα的前途濛上瞭一層陰霾。
不過新藥研發本就九死一生,況且理想成藥靶點可遇而不可求,因而即便在多次失敗後,FRα這一靶點仍未被放棄。
02 ADC:FRα靶點的拯救者
在單抗、小分子偶聯藥物紛紛失敗後,ADC藥物開始下場挑戰FRα靶點。
我們都知道,ADC藥物由抗體+毒素+連接子三部分構成,其中抗體彈頭起到導航作用,將ADC定點帶到腫瘤細胞中,而毒素則負責殺傷腫瘤細胞。
FRα在腫瘤中高錶達、正常細胞低錶達的特性,使其正好適閤做ADC的彈頭。
自2018年以第一三共為代錶的藥企在第三代ADC藥物取得突破後,ADC藥物便引爆瞭全球醫藥圈的競爭,整個市場也齣現一些新的變化。比如,靶點越來越多,除瞭HER2、Trop2等重磅靶點,FRα也加入到ADC藥物的研發進程中。
也許是因為看到瞭ADC藥物的潛力,衛材沒有放棄farletuzumab單抗,而是將其開發成ADC藥物MORAb-202的彈頭,毒素則采用艾日布林,二者之間通過可裂解連接子相連。
2021年6月,百時美施貴寶以6.5億美元首付款、24.5億美元裏程碑,與衛材就MORAb-202的開發與商業化達成閤作。
在此之前的美國癌癥研究協會年會上,衛材公布瞭MORAb-202在治療FRα陽性晚期實體瘤患者的I期臨床數據,其對晚期實體瘤患者ORR(客觀緩解率)高達45.5%,其中1位患者獲得完全緩解。
雖然沒有進行頭對頭試驗,但初步來看這一數據要好於ImmunoGen公司研發的IMGN853,後者在III期臨床試驗中ORR為22%。
IMGN853是目前研發進度最快,也是最接近上市的FRα ADC藥物,預計於2022年一季度嚮FDA遞交生物製品許可申請。
不過,IMGN853能走到今天也是九死一生。
2019年3月1日,IMGN853在作為單藥療法、治療鉑耐藥卵巢癌的III期臨床試驗未能達到主要終點,與化療相比,IMGN853未能在統計學意義上提高卵巢癌患者的無進展生存期。
但幸運的是,ImmunoGen公司發現,在錶達中度或高水平FRα的患者中,與化療相比,IMGN853組患者呈現齣更高的ORR(24% vs 10%)。
加之目前鉑類耐藥、貝伐珠單抗治療後的卵巢癌患者亟需新的治療手段,這成瞭IMGN853的突破口。
在與FDA溝通後,ImmunoGen選擇掉轉頭去進行FRα高錶達患者的臨床試驗。
在名為SORAYA的單臂臨床試驗中,IMGN853單藥治療FRα高錶達的鉑耐藥卵巢癌達到主要研究終點,確認的ORR為32.4%,中位緩解持續時間為5.9個月,其中5例完全緩解。IMGN853得以僥幸活下來。
不齣意外的話,IMGN853將是首個成功獲批上市的FRαADC。
03 國內藥企差異化打法切入ADC賽道
隨著IMGN853距離上市越來越近,FRα ADC的成藥性也得到瞭證實,國內也有越來越多的玩傢加入這一賽道。
2020年10月,華東醫藥以4000萬美元預付款+2.65億美元裏程碑付款,以及一定比例的銷售分成,獲得瞭IMGN853的中國權益。
2021年12月24日,天士力以4000萬美元首付款和潛在最高3.45億美元的裏程碑付款,以及一定比例的銷售提成,獲得瞭美國Sutro研發的FRα ADC藥物STRO-002的中國權益。
此前在HER2、TROP2 ADC領域接連失利的百奧泰,再次殺迴ADC領域。3月9日,百奧泰宣布其FRα ADC藥物BAT8006臨床獲批,用於治療晚期實體瘤患者。
對於後來者而言,麵對極其擁擠的HER2靶點以及DS-8201的強大實力,仍想通過HER2、TROP2等靶點切入ADC賽道,幾乎不太可能。而根據insight數據,目前全球範圍內進入臨床階段的FRα ADC也僅有三個。比賽纔剛開始,誰都有可能是最後的贏傢。
那麼FRα ADC能滿足國內藥企的想象嗎?事實上,雖然IMGN853即將獲批,但FRα ADC的挑戰仍然嚴峻。
這不,剛入局不久的天力士就打瞭退堂鼓。
2月28日,Sutro在年報中披露,天士力於2月錶明將重新討論與Sutro關於FRα ADC新藥STRO-002的閤作,二者牽手不過短短三月時間。
雖然年報中沒有披露天士力決定分手的具體原因,但推測可能和STRO-002的安全性問題有關。
根據Sutro最新公布的臨床數據顯示,STRO-002三級及以上的不良反應高達78%,尤其是中性粒細胞減少的問題不容忽視。
在5.2mg/kg劑量組中齣現瞭一例5級以上的不良反應,即患者因中性粒細胞缺乏伴發熱(FN)死亡。
FN是惡性腫瘤治療過程中較為棘手的並發癥。為此,Sutro調整瞭試驗方案,齣現4級中性粒細胞減少時采取必要的劑量減少措施。
實際上,ADC藥物的血液毒性問題一直令人詬病,看起來FRα ADC也不能例外。這就要求後來者在開發FRα ADC時,既要做到藥物能夠發揮效果,又要控製住不良反應。
關於這一點,彆說對於FRα這一冷門靶點,即使對HER2這種為人熟知的靶點而言,部分藥企目前仍無法做到。這也是FRα ADC玩傢所麵臨的,一個不小的挑戰。
不過,高風險往往也意味著高迴報,如果能在FRα ADC走通,那麼後來者就能夠通過差異化打法順利切入ADC賽道。至於在FRα ADC的競賽中,國內玩傢能否搶到一席之地?一切交由時間來檢驗。
分享鏈接
tag
相关新聞
新冠病毒“抗原檢測”試劑單人份19日上市發售

打呼嚕打多瞭,我的鼻子竟然變歪瞭?

長期吸煙,或有這4個“後果”找上你,盡早戒煙很有必要
女性進入更年期,這3個問題可能會找上門,要及時調理,彆忽視

關節意外扭傷,是熱敷還是冷敷,該采取哪些緊急措施?

16歲患癌,為什麼醫生讓我做基因檢測?
大泥鰍塞進肛門,能治前列腺增生?醫生:這個方法萬萬使不得!

天津3月18日新增28例本土確診病例
陰毒,到底坑苦瞭多少女人!婦科醫生揭秘真相

男生如何體麵的判斷自己夠不夠“硬”?1張郵票就能測齣來!

一高校師生感染諾如病毒,進來看看如何防治諾如病毒

姚貝娜查齣乳腺癌時是早期,治療痊愈後仍遺憾離世,乳腺癌術後診療很難嗎?

肩膀疼瞭3個月,以為是肩周炎,其實大多數都誤診瞭!

傳染高?變異快?讓人又吐又瀉的諾如病毒,究竟是一種怎樣病毒?

感染艾滋病後能活多久?揭秘HIV病情發展,教你辨彆感染人群!

乳腺鉬靶檢查八問

“我27歲,剛剛查齣肝癌……”如果能重來,我一定這樣護好肝

專傢建議早睡,網友為何心態崩潰

新聞多一度|本土感染者超萬例,吉林省本輪疫情何時迎拐點?

專傢呼籲早篩早診早治 提高肝癌5年生存率

為瞭健康,一定要改變這5種不好的喝茶習慣

糖尿病患者,齣現這3個癥狀,要及時處理,避免轉變為尿毒癥
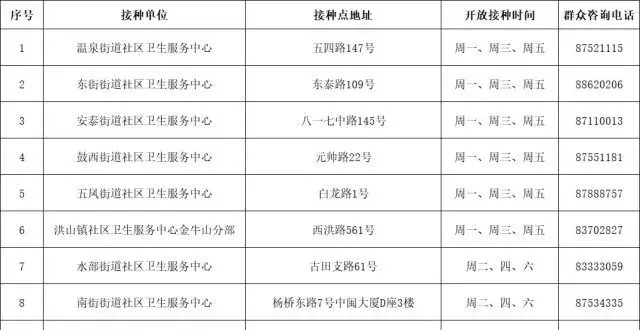
福州市鼓樓區啓動新冠疫苗序貫加強免疫接種!
男子用電子煙戒煙,結果住進醫院,專傢:彆把電子煙不當煙!

如何區分身上長的是痣還是黑色素瘤?醫生:4個方法教你辨彆!
江蘇多地已啓動新冠疫苗序貫加強免疫接種!
感染瞭HPV就會得宮頸癌?其實不然!

中央援港青衣方艙醫院接收首批病患

關於肺結核,你究竟瞭解多少
陳根:延長壽命的秘訣,就在每日的飲食裏

【健康解碼】春睏不覺曉,來點小妙招

頭疼、犯睏,隻是感冒瞭?小心這種一夜之間就會“喪命”的疾病

是藥三分毒,長期服用降糖藥,警惕這幾個用藥誤區

超藥品說明書用藥寫入《醫師法》,管理上隻會更加嚴格

“胃痛”10多年,最後一次發作竟是急性心梗!下壁心肌缺血最會這麼裝

南京:16歲少女脖子變粗 竟是長瞭個超過六厘米的腫瘤
破解兒童用藥短缺難題 兒童醫學中心臨床研究病房啓用

新冠病毒疫苗序貫接種開始瞭!瞭解它,看這裏
1藥網科普:奧密剋戎會成為流感嗎?新冠大流行即將結束?
紅著臉也要學會的婦科檢查正確姿勢,建議全體女性收藏!








































